基因是DNA分子上的功能片段,储存着生命的遗传信息,决定了生命的基本构造和性能,影响着人的生老病死。
Panel 其实是NGS(二代测序,高通量测序技术)技术发展起来的一个词语,主要指同时检测多个基因、多个位点。基因检测的 Panel 官方称之为“基因包”,也可以称之为“基因组合”,商业化的市场习惯称之为“基因套餐”。就基因 Panel 本身来说,其实并没有指明所检测的基因数目应该是多少。几个基因可以是一个 Panel,几十个基因也可以是一个Panel,几百上千个基因也可以是一个Panel。就Panel大小来说,不仅需要看检测基因的数目,还需要看基因所覆盖的区域大小。
肿瘤是机体在各种致瘤因素(包括内部因素和外部因素)共同作用下,机体细胞发生基因突变或表达异常而导致特定组织过度增生的一类疾病。肿瘤从本质上来说是一种基因病。
基因检测是通过特定技术手段,对人体组织、血液、其它体液中的DNA进行检测,目的是使人们能了解自己的基因信息,预估特定疾病患病风险、辅助诊断疾病、指导临床治疗方案的确定。
预估肿瘤患病风险;辅助诊断疾病针对临床怀疑罹患肿瘤的患者;指导临床用药针对准备接受临床药物治疗的肿瘤患者;实时监控正在接受临床治疗的患者随着治疗的进行,肿瘤患者对治疗的敏感性会发生变化。
传统的分子检测方法有Sanger测序,qPCR,ARMs-PCR,FISH和IHC等方法,基因变异类型包含基因点突变、插入缺失、拷贝数变异以及融合等。传统检测方法单次检测样本量、基因个数、变异位点数以及变异类型有限,而最新的二代测序技术能够很好地解决这些问题,该方法具有高通量、多基因、多位点、多变异类型检测等特点,实现了多个药物靶点基因、多种变异形式的平行检测。
NGS技术是二代测序技术的简称,是相对于一代测序技术的一个名称。DNA测序是指通过一定的技术手段分析特定DNA片段的碱基序列,也就是腺嘌呤(A),鸟嘌呤(G),胞嘧啶(C)和胸腺嘧啶(T)的排列方式。二代测序技术由于可以同时对成百上千万条DNA片段同时测序,又叫做高通量测序技术。
毋庸置疑,组织应该是金标准,有组织的情况下,肯定组织优先。按照检出率的话,新鲜组织>石蜡切片>胸腹水细胞>外周血。不过做肿瘤基因检测的话,最主要的还是要考虑临床取样的便捷性!
无法取得组织的话,最好是临床处于中晚期(临床III期后)的患者才适合用外周血进行基因检测。同时,外周血ctDNA检测最好是在没有经过任何治疗之前进行采血检测,放化疗和靶向治疗均会对外周血ctDNA检测结果产生影响。
每种肿瘤基因检测产品(大中小panel)都有自己的优势,在真正选择产品的时候建议大家根据经济条件及患者的情况来选择。比如刚确诊的时候,可以选择几个/几十个基因的panel来进行检测。但是如果晚期多处转移的时候,尤其是耐药的患者,基因突变比较复杂紊乱,可以选择更大的基因panel去检测。如果需要进行免疫治疗,想检查TMB,MSI及MMR的情况,也可以选择大panel进行检测,总之一句话,根据具体的情况来吧,比如肿瘤的类型,检测的目的及意义,经济压力,消费能力等。
测序覆盖度指测序获得的序列占整个panel 基因组 size 比例。由于 Panel 基因组中的高GC、重复序列等复杂结构的存在,测序最终拼接组装获得的序列往往无法覆盖有所的区域,这部分没有获得的区域就称为Gap。比如一个肿瘤panel测序,覆盖度是99%的话,那么还有1%的序列区域是没有通过测序获得的,Gap就是1%。
测序深度指测序得到的总碱基数/待测基因组大小,它是评价测序量的指标之一。假设一个 panel 的 size 为 2.0M,测序深度为 500X,那么获得的总数据量为 1.0G。它的测序深度=总数据量 1.0G/panel 大小 2.0M=500X)。
有效测序深度:不等同于测序深度,是指可信的去除重复序列(dup)后目标区域的平均深度。比如 2.0M 的 Panel Size,下机数据量1.0G,有50%数据落在目标区域(on target),50%为重复序列,那么其测序深度为500X (1.0G/2.0M),有效深度仅为125X(1G*50%*50%/2.0M)。
灵敏度( sensitivity) :指患者中试验阳性者所占比例。对应假阴性率。计算公式:灵敏度( Sen) = a/( a+c)% 。
特异度( specificity) :指没有患病的人中试验阴性者所占比例。对应假阳性率。计算公式:特异度( Spe) = d/( b+d)% 。
检出限(LOD):Limit of detection,是指样品中分析物可被检出的最低的含量,此项指标体现了试剂检测的分析灵敏度。
|
诊断试验 (新方法) |
金标准或参比方法 |
合计 |
|
|
有病或阳(n) |
无病或阴(n) |
||
|
阳性 |
a(真阳性) |
b(假阳性) |
a+b |
|
阴性 |
c(假阴性) |
d(真阴性) |
c+d |
|
合计 |
a+c |
b+d |
a+b+c+d |
提高测序深度可以增加检测灵敏度、特异性,同时提高检出限,但不能突破极限检出限。在DNA量一定的情况下,满足一定量测序深度后,检出限存在理论极限值,单纯通过增加测序深度并不能降低检出限,盲目加大测序深度只会产生更多的重复(duplication),造成数据浪费,所以测序深度并非越深越好。比如 ctDNA上样量为 33ng(10000拷贝),文库构建转化率50%,就是5000个拷贝,测序深度增加再深,理论上最多也只能测出5000个拷贝,LOD也不可能达到万分之一的。
不是的,这个之前也说过很多次。目前有接近一半的的靶向药,比如CDK4/6靶点的靶向药,索拉非尼、瑞戈非尼、卡博替尼等多靶点的抗血管生成靶向药物,使用前无需做基因检测。大家也可以去翻阅 2018年9月21日,国家卫健委(原国家卫计委)发布的《新型抗肿瘤药物临床应用指导远侧(2018年版)》。不过,对于有明确疗效/耐药靶点的药物,须遵循基因检测后才可使用!不得在未做相关基因检测的情况下盲目用药哦!
肿瘤基因检测的主要原因在于肿瘤是一类高度异质性疾病。也就是说,哪怕患的是同一种肿瘤,不同的患者也需要根据其实际情况采用不同的治疗方案,尤其是抗肿瘤用药的选择。不同患者对不同抗肿瘤药物的敏感程度差异巨大,故肿瘤临床治疗需要制定个体化的精准方案。而基因检测是评估患者使用药物效果非常重要的一环,能从分子层面给医生用药予精确的指导。
基因检测的方法是直接与基因检测类型相关联的,每种基因检测类型都有较为合适基因检测方法。由于基因检测体系比较复杂,最好的方法是根据需要评估的药物选择相应的检测项目。简单总结一下各个基因检测类型对应的常见检测方法:
(1)基因检测的方法是直接与基因检测类型相关联的,每种基因检测类型都有较为合适基因检测方法。由于基因检测体系比较复杂,最好的方法是根据需要评估的药物选择相应的检测项目。简单总结一下各个基因检测类型对应的常见检测方法:
(2)基因检测的方法是直接与基因检测类型相关联的,每种基因检测类型都有较为合适基因检测方法。由于基因检测体系比较复杂,最好的方法是根据需要评估的药物选择相应的检测项目。简单总结一下各个基因检测类型对应的常见检测方法:
(3)基因检测的方法是直接与基因检测类型相关联的,每种基因检测类型都有较为合适基因检测方法。由于基因检测体系比较复杂,最好的方法是根据需要评估的药物选择相应的检测项目。简单总结一下各个基因检测类型对应的常见检测方法:
(4)基因检测的方法是直接与基因检测类型相关联的,每种基因检测类型都有较为合适基因检测方法。由于基因检测体系比较复杂,最好的方法是根据需要评估的药物选择相应的检测项目。简单总结一下各个基因检测类型对应的常见检测方法:
(5)基因检测的方法是直接与基因检测类型相关联的,每种基因检测类型都有较为合适基因检测方法。由于基因检测体系比较复杂,最好的方法是根据需要评估的药物选择相应的检测项目。简单总结一下各个基因检测类型对应的常见检测方法:
(6)基因检测的方法是直接与基因检测类型相关联的,每种基因检测类型都有较为合适基因检测方法。由于基因检测体系比较复杂,最好的方法是根据需要评估的药物选择相应的检测项目。简单总结一下各个基因检测类型对应的常见检测方法:
液体活检主要有3个步骤:1.抽取患者10ml的外周血;2.利用DNA提取技术获得血液中的cfDNA,通过高通量测序技术获得测序数据,运用生物信息学方法解读测序数据,获得肿瘤相关基因的变异信息;3.根据基因变异信息出具临床检测报告,作为患者靶向治疗的参考和依据。
利用手术或穿刺方式获取组织样本进行检测对患者的身体伤害大。而液体活检只需要抽一管血就能进行检测,它不会对患者造成较大的伤害,因此能够多次取样,多次检测,从而实现对患者病情的动态监测,为临床治疗提供更多的参考。
液体活检是取患者的外周血进行检测,对患者是无创的,适合晚期病人的初诊及复发监控;组织活检是一项非常成熟的检测技术,是对患者的组织标本进行检测,无论是手术或者穿刺获取组织标本,都是有创的,对病人有一定的伤害。
肿瘤的驱动基因指调控细胞生长的某个重要基因发生了改变(突变,扩增,重排等),导致原癌基因的激活以及抑癌基因的失活。这些改变了的基因导致了正常细胞转化为肿瘤细胞,就叫做肿瘤驱动基因。
不同癌症的肿瘤驱动基因不一定相同。以非小细胞肺癌为例,其常见的肿瘤驱动基因有EGFR,ALK,HER2,MET,RET,ROS1,BRAF以及KRAS等。
化疗是对所有细胞产生影响,我们建议大家在化疗后至少3天,一般5-7天来采集血液,或者在下一次化疗前3天左右采样。否则释放到血液中的肿瘤DNA少了,可能会导致假阴性的结果。取穿刺样本也是一个道理。靶向药的话由于间隔时间比较短,不做特殊规定,但是也请大家尽量在下一次即将吃靶向药前来采血。
根据美国疾控中心的定义,肿瘤早筛是指“在尚无症状时,检查身体是否有癌症存在”。现代医学对肿瘤晚期患者的治疗手段非常有限,肿瘤真正事半功倍的办法,是“早诊早治”。多数肿瘤,如果早期得到诊断,并进行规范的治疗和健康管理,基本可以实现治愈。某权威肿瘤医院发布的生存数据显示:早期宫颈癌、大肠癌患者经过规范治疗,五年生存率均可以达到90%以上;早期乳腺癌甚至可以达到97%以上。需要进行肿瘤早期筛查的重点人群包括:45岁以上;肿瘤家族史(3代以内近亲有癌症病史);工作性质长期接触(粉尘、苯、铅等)有害物质;慢性病病人(各类癌前病变等),等等。
肿瘤有两种发生情况,一种是由于后天因素导致的,一种是由于先天遗传因素导致的,这种先天遗传因素导致的肿瘤就叫做遗传性肿瘤。比如一个家族中,连续几代人都有出现癌症,就很可能是家族遗传性肿瘤。
如果肿瘤具有遗传性,如何让子女防控肿瘤的发生呢? 肿瘤是一种基因病,由于某些基因发生变异,进而生长失控,从而导致肿瘤的发生。某些基因的突变具有遗传性,这些带有遗传易感基因的人群,罹患肿瘤的风险,比正常人高很多。由于遗传易感基因导致的肿瘤,占所有肿瘤的5-10%。具有明显遗传倾向的肿瘤有20余种,比较常见的包括:卵巢癌,乳腺癌,结直肠癌,胰腺癌,前列腺癌,胃癌等。遗传易感基因,可以通过胚系基因检测检出。如肿瘤患者查出具有遗传易感基因,应尽快让其子女进行相关基因的检测。对于携带遗传易感基因的健康人群,可在医生的指导下,进行早期治疗和健康管理,可有效延缓甚至避免肿瘤的发生。
TMB(肿瘤突变负荷)高的肿瘤患者,使用免疫检查点抑制剂获益更高,更适合使用免疫检查点抑制剂进行治疗。携带PBRM1、POLE基因突变的患者,使用免疫检查点抑制剂,获益更高。携带JAK1、JAK2、BM2、HLA、STK11等基因突变的肿瘤患者,可能对免疫检查点抑制剂耐药,所以要提前检测一下。携带EGFR突变、MDM2扩增的肿瘤患者,使用免疫检查点抑制剂,可能使肿瘤发生进展。因此,在选择免疫检查点抑制剂治疗之前,做基因检测,很有意义。
肿瘤组织内的基因,持续不断的发生着变异,而且突变过程是完全随机的。有效的治疗手段,会影响突变发生的频率,减少有害突变发生的几率。因此,治疗一段时间以后,在发生耐药、疾病进展的情况下,可以再进行基因检测,以发现是否有新的基因突变,进而采取新的治疗手段。
肿瘤具有异质性。患者在治疗后,由于药物的选择压力,肿瘤细胞发生演化,造成肿瘤突变状态在治疗前后存在差异(时间异质性)。对于同一患者同一肿瘤灶内,以及原发灶和转移灶之间基因突变状态存在差异(空间异质性)。肿瘤的时空异质性可能会导致治疗效果不佳及疾病复发。
ctDNA 在一定程度上克服肿瘤的空间异质性。同时检测多种变异形式,包括点突变、插入缺失、拷贝数变异、融合。通过这种动态监测肿瘤分子变异情况,最大程度保证治疗的有效性和及时性。
(1) 评价靶向用药的疗效:靶向用药有明确的基因靶点,通过检测特定基因靶点的丰富变化,来评价药物疗效。
(2) 靶向药物的耐药和病灶复发:对于靶向药物有明确耐药机制的新基因突变,可以通过检测耐药基因突变来评估耐药复发的风险。
(3) 液体活检技术的发展:无创基因检测的方式,使得连续的监测成为了现实,突破了组织检测的限制。
(4) 分子检测具有高灵敏性,早发性,临床文献显示比传统的影像学检测肿瘤的复发早半年到一年的时间。
靶向药物都针对明确的基因突变位点。患者基因突变的类型和靶向药物必须匹配,才能从靶向药物中获益,否则不仅靶向药物无效,还会增加药物毒副作用,耽误患者最佳的治疗时间。就像一把钥匙对应一把锁,应该首先知道是什么锁,才去选合适的钥匙。如果拿错了钥匙,那就会浪费宝贵的时间精力。
肿瘤复发一般都伴随新的基因突变出现,需要知道新的基因突变是什么,知道新的用药方案,如何更换靶向药物,就需要进行第二次基因检测。 举个例子:使用EGFR靶向药物的EGFR突变肺癌患者,平均一年左右产生耐药性。其中一半患者是由于 EGFR基因出现了新的T790M突变,如果二次基因检测发现了这种突变,就可以使用第三代EGFR靶向药物。但如果是其他突变,比如c-MET基因扩增,就需要考虑克唑替尼了。这就是二次基因检测的目的所在。
奥明基因的化疗报告是根据患者的遗传背景来进行化疗药物的推荐,包括药物的有效性预测和毒副风险预测。
一般来说,医生有几套成熟的备选化疗方案,在此基础上,结合我们的化疗药物报告来综合选择其中一套适合患者的化疗方案。有两层意思:
(1) 首先医生有成熟的备选方案,以医生的方案为主。
(2) 医生备选的方案哪个更适合患者,医生可能没有很好的判断标准或者医生认为最好的化疗方案可能不一定适合该患者,可以结合我们的化疗报告来确定哪个化疗方案更加适合该患者的治疗,提高药物的疗效,降低药物的毒副风险。比如,临床医生治疗胃癌的病人,用两套化疗方案,第一套是奥沙利铂、亚叶酸钙和替吉奥,第二套是多柔比星、亚叶酸钙和替吉奥,医生首选是第一套化疗方案。我们的报告提示患者服用奥沙利铂的毒副风险较高,而多柔比星的疗效较好,毒副风险较低,所以医生结合我们的报告优选了第二套方案来进行临床治疗。
虽然液体活检有很多好处,取样方便又快捷,但是组织活检仍然是肿瘤基因检测的金标准,因此收样的时候最好是新鲜组织。新鲜组织>石蜡切片>胸腹水上清>胸腹水细胞>外周血。在收取新鲜组织和石蜡切片组织的时候要保障肿瘤细胞含量≥20%,这样检测出的结果更可信。
一般采集血液样本是为了提取白细胞DNA来作为正常对照基因组,通过对比组织DNA和白细胞DNA检测结果,去除胚系突变和造血干细胞突变得到肿瘤体细胞突变情况。不仅可以通过白细胞对照除去,还可以通过生信分析算法除去胚系突变的干扰。我们采用的是后者,就是通过生信分析除去胚系突变的干扰,从而找到体细胞突变,因此在采集组织样本的时候无需采集血液样本。
有文章做了一万五千多例的病例,结果发现组织和血液的一致性达到90%左右。越是取样时间接近的一致性越高,时间久了之后一致性下降,可能解释就是出现新的突变。而组织是之前的,没有办法反应出来。
(1) 癌种本身的关系:非头颈部实体瘤(无血脑屏障)和头颈部肿瘤(有血脑屏障),释放到外周血中的ctDNA 丰度差异非常大;同时非头颈部实体瘤内,不同癌种释放到外周血中的ctDNA丰度差异也非常多,这是癌种本身的特性所致。
(2) 癌种分期:相较于一期和二期,三期和四期非头颈部实体瘤释放到外周血中的ctDNA浓度更高,血液和组织的一致性非常高。目前基于已经发表的文献,三期和四期肺癌、结直肠癌、乳腺癌等肿瘤患者,血液和组织一致性在80~100%之间。
(3) 组织检测阴性,血液检测阳性,原因可能是:排除掉二者技术本身带来的可能偏差,如技术平台不一致、质控手段不一致、检测灵敏度和特异性不一致等因素外,以及取样时间关系外(组织检测与血液检测时间间隔不得大于2月以上),肿瘤组织本身的高度异质性,使得活体取样代表性不足,漏掉了部分突变信息,但由于外周血参与循环,具有均一性,代表性更加全面,因此会出现组织检测阴性而血液检测阳性的结果。
(4) 组织检测阳性,血液检测阴性,除了癌症不同分期(早期患者血液中ctDNA浓度可能较低)之外,原因可能是:首先确定组织检测和血液检测二者使用的技术平台的灵敏度。目前NGS的检测灵敏度为1/1000,ARMS-PCR检测灵敏度为1/10000,有可能是二者检测阈值导致的结果不一致;其次,确定二者检测时间间隔,如果间隔大于2周,需要重新提供样本,在进行检测结果比对,因为肿瘤本身突变是动态演化的,且在治疗过程中,各种治疗手段,对肿瘤本身的突变改变也有相应关系;最后使用多种手段,排查组织检测结果是否出现假阳性。
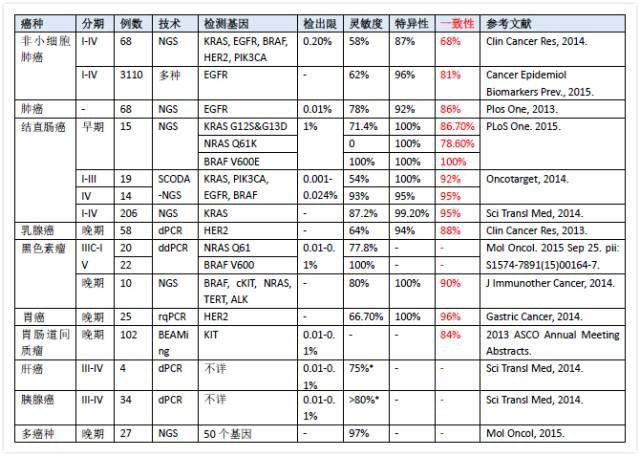
不同癌种液体活检和组织活检的检测结果比较
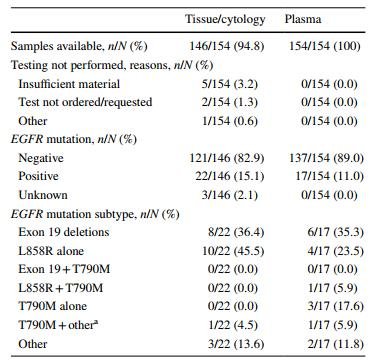
NSCLC患者中组织活检和液体活检的比较
如结直肠癌,是用血液比较好,因为结直肠癌的肿瘤很多,在取肿瘤组织时有可能取到癌旁组织,不能确保所取组织为原发灶。不管是什么癌种,当病理科有已经检测的切片时,最好是取切片,因为切片的肿瘤细胞含量大于70%,我们的检测结果会更加真实。当病人刚刚完成手术,建议取组织,当手术完成2周后才建议取外周血。
无法取得组织的话,最好是临床处于中晚期(临床III期后)的患者才适合用外周血进行基因检测,同时,外周血ctDNA检测最好是在没有经过任何治疗之前进行采血检测,放化疗和靶向治疗均会对外周血ctDNA检测结果产生影响。
肿瘤患者体内,肿瘤细胞在凋亡或坏死后,ctDNA释放进入外周循环系统(血清和血浆),通过富集并提取血浆中的cfDNA片段(含正常细胞DNA和肿瘤细胞ctDNA),进行高深度高通量的基因测序,可以获得cfDNA的序列信息和突变信息。通过生信分析获得肿瘤细胞ctDNA基因突变信息,包括突变、缺失、插入、重排、拷贝数异常等。目前,基于NGS技术的ctDNA检测已在大量临床实验中得到了证实,并经NCCN指南、ASCO、CSCO会议和中国的一些专家共识推荐进入临床应用。
奥明基因 ctDNA 检测基本技术参数:灵敏度达到99%,特异性到达90.64%,准确度达到92.78%,测序深度 10000x。无论是组织还是血液ctDNA检测,奥明基因肿瘤精准用药基因检测产品在灵敏性和特异性、方面都具有较高的水平。
切除肿瘤组织手术之后,有可能存在残留病灶释放的ctDNA,假如能检测出用药信息,说明有用药指导意义,也可以通过检测该信息进行预后监测。
还可以针对非小细胞肺癌、结直肠癌、乳腺癌、卵巢癌等具有靶向用药的癌种进行单基因的用药指导,比如非小细胞肺癌患者针对EGFR、ALK、ROS1等基因的用药指导;结直肠癌针对KRAS/NRAS/BRAF的三基因用药指导,乳腺癌、卵巢癌和胰腺癌针对BRCA1/2的PARP抑制剂的用药指导,以及对乳腺癌患者化疗用药风险评估的乳腺癌21基因检测;以及针对结直肠癌早期筛查的Septin 9基因的检测;CTC肿瘤循环细胞检测;关于免疫治疗的PD-1/PD-L1的蛋白水平检测。
针对非小细胞肺癌患者,不推荐其只做单基因检测,最好做三基因或小panel检测,因为NCCN指南上表明,针对KRAS突变的NSCLC患者对EGFR-TKI不敏感;对于存在ALK或ROS1融合的患者不推荐使用EGFR-TKI进行后续的治疗。
肿瘤的发生发展是由多种基因突变驱动导致的结果,与肺癌相关的基因突变并不只有以上所说的三种。76%的肺腺癌患者可见RTK-RAS信号通路的改变,其中EGFR、KRAS、BRAF、RET、MET等基因已明确与腺癌临床诊疗的相关性。但是一些基因的突变可能对其他基因对应的靶向药物的疗效也有影响,如肺癌中,KRAS密码子12、13、61突变的患者对EGFR-TKI药物(吉非替尼、厄洛替尼、埃克替尼、阿法替尼)的敏感性降低;PIK3CA激活突变导致患者对EGFR-TKI耐药;PTEN失活突变可能导致对EGFR-TKI耐药;非小细胞肺癌中,ERBB2扩增是导致EGFR突变的患者对EGFR抑制剂产生耐药的机制之一等。所以肺癌精准用药指导的基因检测并不是检测EGFR、ALK、ROS1这三种基因突变就可以的,需要获得全面的肿瘤基因变异信息从而最大程度的发现潜在可用的靶向药物来提高治疗的有效性。
奥明基因检测的肺癌16基因包括的基因都是与肺癌相关的具有明确用药指导意义的基因;肺癌32基因检测包括获批靶向药物和临床在研药物的相关基因,为医生和患者提供准确全面的肿瘤基因变异信息和用药参考信息,从而最大程度发现潜在可用的靶向药物和提高治疗的有效性。
小panel(肺癌16基因和肠癌16基因)是根据肺癌和结直肠癌的靶向用药检测,是针对NCCN指南推荐的肺癌和结直肠癌靶向用药基因的检测。建议初次进行基因检测得患者,或者使用治疗手段较少的患者进行检测,或者经济条件有限的患者。
中panel(肺癌32基因、肠癌35基因、乳腺癌68基因、实体瘤68基因和实体瘤110基因)不仅包含NCCN指南推荐的靶向而且包含在使用癌种中突变频率较高而且具有致病突变的基因,还包括23个化疗用药相关基因,通过检测对化疗用药毒副作用进行评估,筛选出毒副作用小,效果好的用药方案。
大panel(实体瘤589基因)不仅包括靶向用药基因和化疗用药基因,还包括关于免疫治疗检测点的相关基因和免疫检测标注物如TMB、MSI和PD-1/PD-L1表达等以及关于PARP抑制剂的筛查。针对多个癌种,不仅局限于常见的肺癌、肠癌、乳腺癌,还包括卵巢癌、胰腺癌、甲状腺癌、肝胆癌等其他癌种。推荐经过多种治疗手段的患者和出现耐药的患者。
癌症是复杂的多基因的疾病,很多驱动基因的突变都可能造成癌症的发生。单基因检测不能涵盖所有的突变类型。
(1) 单基因检测是碰运气的方式,突变基因的漏检率和阴性率比较高,信息单一片面。多基因检测是穷尽的方式,将与肿瘤突变和用药相关的驱动基因一次检测完毕,信息全面综合,很好的反映患者的整体情况,同时检测指导用药的基因突变率比单基因检测高。
(2) 提高病人样本的利用率。一份样本就可以检测很多基因的突变情况,比单基因检测节约病人的宝贵样本,特别是临床样本比较珍贵时。
(3) 性价比高。多基因套餐的价格会高于单基因检测价格,但是平均到单个基因的价格,多基因的性价比明显高于单基因检测,减轻患者经济负担。
(4) 检测灵敏度更高。单基因检测一般利用qPCR检测,灵敏度为最高为1%,而多基因检测用的是二代测序技术,灵敏度最高为0.1%,检测变异的能力为单基因检测技术的10倍。
采样前须与患者和医生做好沟通,使其了解检测结果可能会出现的所有情况。
检测结果出现全阴性,可能有两方面原因:
(1) 送检样品中的肿瘤细胞比例达不到要求,例如新鲜手术组织或者穿刺组织(取样时取到癌旁组织);
(2) 检测结果确实是阴性,患者有可能携带DNA分子水平以外的异常信息,可联合其他检测手段进行评判。
对于检测结果全阴性的解释:
(1) 并不是所有的突变基因都存在靶向用药。科学数据表明,部分患者不存在明确的靶向药物对应基因突变,所以并非所有受检者都携带靶向药物对应的基因突变信息。全阴性的检测结果最容易在肺癌靶向用药检测中出现,肺癌中EGFR突变占40-50%,ALK融合突变占3-7%,ROS1融合占1-3%,综合来看,肺癌病人在检测基因突变时,有40%的可能为全阴性。各期NSCLC患者中均能一定程度检出ctDNA突变,II~IV期患者可100%检出突变,I期患者50%可检测出突变。基因突变的检出与肿瘤的体积变化和疾病进展密切相关。76%的肺腺癌患者可见RTK-RAS信号通路的改变,其中EGFR、KRAS、BRAF、MET基因等已明确与腺癌临床诊疗的相关性。并且有进一步的分析指出对于吸烟和不吸烟的肺腺癌患者,EGFR和KRAS的突变频率存在差异,相对于吸烟患者,不吸烟患者的EGFR突变频率更高而KRAS突变频率较低。
(2) 阴性结果并非没有结果,而是经过DNA提取、建库和序列测定后所得DNA信息与参考基因组信息比对后的结果,提示患者无特定靶向药物信息,可以避免盲目使用昂贵的靶向药物,不仅患者没有疗效,反而有用药的毒副作用。我们的检测结果不具有直接的临床诊断权利,需要临床医生结合患者的情况和基因检测结果来综合决策。
(3) 全阴性的检测结果并不代表没有推荐的药物信息。NCCN推荐EGFR/ALK/ROS1阴性且PD-L1表达≥1%的患者,一线可以直接选用PD-1药物帕利珠单抗用药。治疗失败后可更换化疗。EGFR/ALK/ROS1靶向治疗失败后的患者在选用PD-1单抗时要求肿瘤PD-L1高表达(≥50%),增加了药物适用人群的筛选。
乳腺癌是遗传性的癌症,跟BRCA1/2基因高度相关,我们的乳腺癌风险筛查产品BRCA1/2对全外显子进行检测,判断对应的风险,以针对性地预防。
部分肿瘤是遗传性的(如20%左右的乳腺癌、卵巢癌、部分结直肠癌),通过基因检测可以判断该个体是否携带遗传自父母的“坏”的基因,携带了此类基因的人,他们比常人有更高比例患癌症的风险。一旦检查出来后,他需要加强对自己的常规体检频率,同时在必要的时候,需要采取措施进行医疗干预,但是这些都必须有临床医生的指导。
非遗传性的肿瘤也可以在影像学上还没有发现临床指证的时候,通过液态活检(如ctDNA检测),揭示基因突变的频率,提前预知风险;一个正常的细胞,从最初一个细胞里的基因突变,到最终通过影像学诸如PET-CT检测出来的时候,可能有8-10年的时间,但这之间会通过血液里的DNA提前进行判断,这在目前称之为癌症早筛。
我们根据基因检测的结果为患者提供客观的用药信息,对于药物的具体来源和购买途径可咨询医生和相应的药物生产商或经销商。